
-
Rozwój produktu leczniczego
-
Badania kliniczne
-
Jakość
-
Audyty GxP
-
Usługi Rejestracyjne
-
Wsparcie przedrejestracyjne
- Usługa Scientific Advice
-
Druki informacyjne
-
Dokumentacja rejestracyjna
- Audyt dossier
- Proces rejestracji
- Obsługa porejestracyjna
- Regulatory outsourcing
-
Wsparcie przedrejestracyjne
-
Pharmacovigilance
-
Usługa QP / Import
Import i zarządzanie łańcuchem dostaw
W przypadku podmiotów odpowiedzialnych (ang. Marketing Authorisation Holder; MAH), które chcą wprowadzić swoje produkty lecznicze na rynek Unii Europejskiej/ Europejskiego Obszaru Gospodarczego, a wytwarzają je poza terytorium Unii Europejskiej/ UE/EOG, wymagane jest posiadanie importera produktu leczniczego odpowiedzialnego za certyfikację serii.
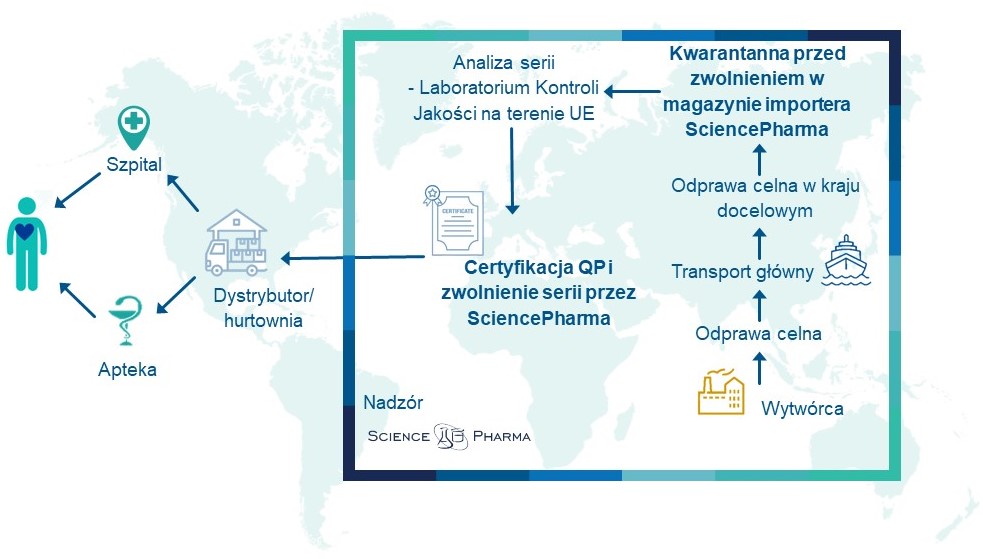
Import produktów leczniczych do krajów UE jest jedną kluczowych usług oferowanych przez SciencePharma na rzecz wprowadzania na rynek europejski produktów leczniczych z krajów trzecich. W SciencePharma świadczymy usługi importowe w sposób kompleksowy i zapewniamy zgodność procesy z regulacjami prawnymi UE oraz GMP/GDP.
Unijne wymagania GMP dla importera produktów leczniczych wytwarzanych poza UE
Wymagania obowiązujące przy imporcie produktów leczniczych do UE zostały opisane w wytycznych UE GMP i podsumowane w nowym Aneksie 21 (EU GMP Annex 21), który wszedł w życie w sierpniu 2022 r. Zgodnie z Aneksem 21 w ramach procesu importu wyróżniamy:
- miejsce certyfikacji serii lub – w przypadku produktów luzem lub produktów pośrednich, które są dalej przetwarzane – potwierdzenia etapu wytwarzania przez QP,
- miejsce fizycznego importu, którego podstawową rolą jest magazynowanie importowanego produktu leczniczego do czasu jego zwolnienia na rynek EU.

Importer UE – licencja MIA i farmaceutyczny system jakości zgodny z GMP
Ze względu na specyficzne wymaganie importowe, wskazane powyżej miejsca zobowiązane są do posiadania Licencji MIA (z ang. Manufacturing & Import Authorisation Licence) oraz odpowiedniego farmaceutycznego systemu jakości zgodnego z wymaganiami Dobrej Praktyki Wytwarzania produktów leczniczych (GMP), wdrożonego z uwzględnieniem zakresu prowadzonej działalności.
W SciencePharma spełniamy ten wymóg. Posiadamy kwalifikacje odpowiadające potrzebom naszych Klientów spoza UE. Zatrudniamy wysoce doświadczonych specjalistów, którzy potrafią kompleksowo przeprowadzić proces importu. SciencePharma posiada własną licencję MIA, a w razie potrzeby możemy również polegać na licencjach MIA naszych sprawdzonych, długoterminowych Partnerów świadcząc kompleksowe usługi dla wszystkich niezbędnych działań importowych.
SciencePharma świadczy usługi importowe w zakresie organizacji transportu, magazynowania, dystrybucji i zarządzania łańcuchem dostaw na całym świecie

Nasi eksperci posiadają bogate doświadczenie w zarządzaniu importem produktów leczniczych. Pracujemy zgodnie z Dobrą Praktyką Wytwarzania (ang. Good Manufacturing Practice, GMP) oraz Dobrą Praktyką Dystrybucyjną (Good Distribution Practice, GDP). Świadczymy usługi importowe na całym świecie w szerokim zakresie czynności. Organizujemy transport, nadzorujemy magazynowanie i dystrybucję produktów leczniczych oraz świadczymy usługi zarządzania łańcuchem dostaw. Istotną część naszej działalności są również badania kontrolne serii, wykonywane w kontraktowych laboratoriach kontroli jakości zlokalizowanych na terenie całej UE.
Posiadamy wiedzę i doświadczenie w szerokim zakresie czynności związanych z importem, obejmujących:
- transport (lotniczy, drogowy, morski i kolejowy) we współpracy ze sprawdzonymi firmami spedycyjnymi,
- odprawy celne we współpracy z Agencjami Celnymi (w krajach wytwarzania i na rynkach docelowych),
- ocenę warunków przechowywania,
- magazynowanie produktu w miejscu fizycznego importu,
- zarządzanie reklamacjami i wadami jakościowymi,
- nadzór nad alertami serializacyjnymi,
- zlecanie i nadzorowanie badań kontroli jakości,
- zarządzanie transferami metod analitycznych do laboratoriów zlokalizowanych na terenie UE
- organizację i zarządzanie magazynowaniem produktów leczniczych,
- kompleksowy nadzór i optymalizację łańcucha dostaw pod kątem oszczędności czasu i kosztów,
i wielu innych zadań, które należy wykonać wprowadzając produkt leczniczy na rynek UE. Oczywistą i istotną częścią naszej działalności importowej jest wykonywanie analiz serii (ang. batch analysis) w kontraktowych Laboratoriach Kontroli Jakości zlokalizowanych na terenie całej UE. Dla realizacji kompleksowej usługi świadczymy również najwyższej jakości usługi certyfikacji serii (ang. Qualifited Person Service, QP Service) oraz zwolnienia partii (ang. batch release).
Ponadto świadczymy także usługi nadzoru nad procesem dystrybucji zgodnie z GDP, począwszy od momentu zamówienia produktu leczniczego, poprzez proces importu po jego magazynowanie. Kontrolujemy wszystkie kwestie związane w logistyką i zapewniamy zachowanie jakości dystrybuowanych produktów na poziomie spełniającym wymagania GDP podczas całego procesu dystrybucji.
Nasi specjaliści posiadają praktyczną wiedzę również w zakresie pozyskiwania z rynku i transportu produktów referencyjnych potrzebnych do rozwojowych badań CMC (ang. chemistry, manufacturing, and controls) oraz do badań klinicznych – zarówno z UE, jak i z krajów trzecich.
W przypadku badanych produktów leczniczych (ang. investigational medicinal products, IMP), organizujemy dystrybucję IMP do badań klinicznych, zapewniamy dostawę IMP do poszczególnych ośrodków klinicznych w odpowiednio kontrolowanych warunkach, zgodnie z obowiązującymi przepisami prawa i zaleceniami GMP/GDP. Oferujemy również usługi koordynację przepakowywania badanych produktów leczniczych do badań klinicznych zgodnie z GMP.
Nasi eksperci mają doświadczenie w wytwarzaniu i imporcie produktów leczniczych na całym świecie
SciencePharma świadczy usługi dla małych, średnich i dużych firm farmaceutycznych zlokalizowanych na całym świecie. Nasi eksperci posiadają doświadczenie w działalności produkcyjnej i importowej, obsługując Klientów z krajów trzecich wytwarzających swoje produkty lecznicze w krajach położonych w Azji i Ameryce Południowej, w USA oraz w krajach europejskich poza terytorium UE. Naszym atrybutem jest dogłębna znajomość prawa UE oraz krajowych wymogów prawnych, procedur i oczekiwań agencji rejestracyjnych w krajach UE, co jest podstawą sukcesu zarówno w imporcie produktów, jak i w całościowym farmaceutycznym wsparciu regulacyjnym i zarządzaniu projektami.
Planujesz import produktów leczniczych? Jesteśmy tutaj, aby pomóc Ci we wszystkich wyzwaniach związanych z wymaganiami prawnymi, transportem i odprawą celną.
Współpracując z nami otrzymujesz gwarancję sprawnego i bezproblemowego importu.
Powierz załatwienie wszelkich formalności importowych w doświadczone ręce.

