
-
Rozwój produktu leczniczego
-
Badania kliniczne
-
Jakość
-
Audyty GxP
-
Usługi Rejestracyjne
-
Wsparcie przedrejestracyjne
- Usługa Scientific Advice
-
Druki informacyjne
-
Dokumentacja rejestracyjna
- Audyt dossier
- Proces rejestracji
- Obsługa porejestracyjna
- Regulatory outsourcing
-
Wsparcie przedrejestracyjne
-
Pharmacovigilance
-
Usługa QP / Import
Ocena Ryzyka dla Środowiska Naturalnego
W ostatnich latach obserwujemy generalne zwiększenie świadomości społecznej w zakresie ochrony środowiska, a przemysł farmaceutyczny już od dawna wyróżnia się dbałością o ten aspekt życia. Organy regulacyjne skupiają się nie tylko na bezpieczeństwie pacjentów, ale biorą również pod uwagę wpływ produktu leczniczego na całe środowisko. Ocena ryzyka dla środowiska naturalnego (ang. Environmental Risk Assessment, ERA) ma na celu ustalenie potencjalnych zagrożeń dla środowiska wynikających ze stosowania, przechowywania i usuwania produktów leczniczych (Rys.1).
Kiedy jesteś zobowiązany do przedłożenia Oceny Ryzyka dla Środowiska Naturalnego (ERA)?
Zgodnie z Art. 8(3) Dyrektywy 2001/83/WE, każdy wniosek o pozwolenie na dopuszczenie do obrotu produktu leczniczego w UE, zarówno w ramach procedury scentralizowanej, wzajemnego uznania (ang. mutual recognition procedure, MRP), zdecentralizowanej (ang. decentralised procedure, DCP) czy też narodowej, musi zostać złożony wraz z odpowiednią oceną ERA zatwierdzoną przez Eksperta. Według NTA, tom. 2B-CTD, ocenę ERA należy przedłożyć w module 1.6.1 (dla produktów leczniczych, które nie zawierają GMO (organizmów genetycznie modyfikowanych)) lub module 1.6.2 (dla produktów zawierających lub składających się z GMO, ang. Genetically Modified Organisms ). Ocena ERA jest również wymagana w przypadku zmian typu II lub rozszerzeń, jeśli istnieje potencjalny wpływ na środowisko (np. dodanie nowego wskazania). W przypadku rejestracji czy zmiany typu IA/IB nie ma konieczności przedkładania ERA, chyba że związane są one z potencjalnym wzrostem użycia substancji czynnej.
SciencePharma ma duże doświadczenie w ocenie, czy przedstawiona przez Podmiot odpowiedzialny ERA jest wystarczająca dla procedur rejestracyjnych w EU na poziomie krajowym jak i międzynarodowym (DCP, MRP, centralny). W ramach wykonywanej oceny możemy wskazać jakich elementów brakuje w dokumencie i które kwestie mogą wywołać pytania Ekspertów oceniających. Poza wykonywaniem oceny gotowego ERA, możemy również przygotować moduł 1.6 od samego początku, wraz z wymaganą analizą ryzyka. W zależności od wyników oceny ERA zapewniamy również doradztwo odnośnie konieczności podjęcia dalszych kroków związanych z ochroną środowiska.
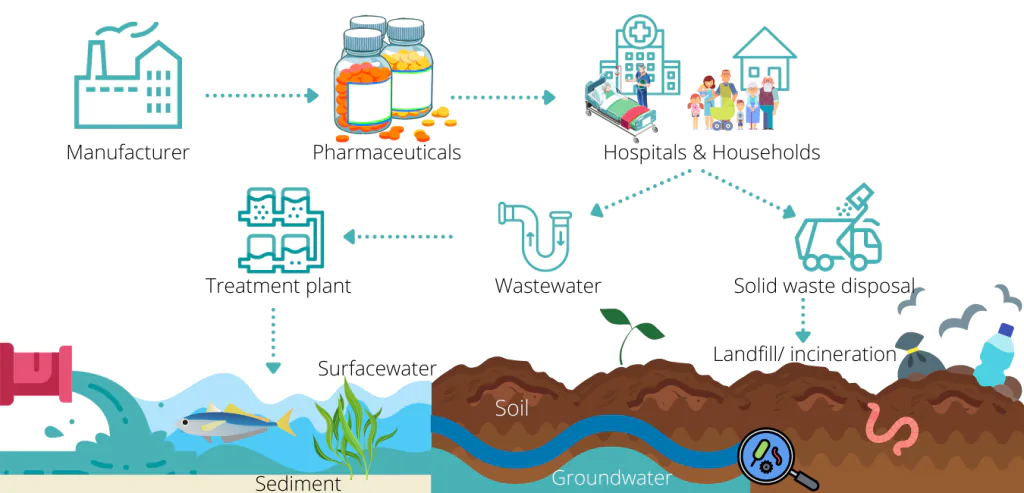
Rys.1. Narażenie środowiska naturalnego wynikające ze stosowania, przechowywania i usuwania produktów leczniczych.
Jakie dokumenty regulują wymagania ERA?
Ocena Ryzyka dla Środowiska Naturalnego regulowana jest przez wytyczne: Guideline on the environmental risk assessment of medicinal products for human use i Guideline on environmental risk assessments for medicinal products consisting of, or containing, genetically modified organisms (GMOs) i inne dokumenty towarzyszące (takie jak m. in. Q&A), przygotowane przez Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (Committee for Medicinal Products for Human Use, CHMP). Skupiają się one głównie na ekspozycji środowiska na działanie substancji leczniczej (w obrębie gleby, wód powierzchniowych i gruntowych), jej losie i wywoływanych przez nią skutkach środowiskowych (np. na glony, Daphnia, ryby, drobnoustroje). Ocena potencjalnego ryzyka dla środowiska składa się z dwóch etapów.
- Pierwszy etap obejmuje określenie zagrożenia w kontekście trwałości, bioakumulacji, toksyczności (ang. Persistence, Bioaccumulation, Toxicity, PBT) oraz obliczenie przewidywanego stężenia w środowisku (ang. Predicted Environmental Concentration, PEC).
- Drugi etap polega na analizie dalszych losów i skutków dla środowiska. Jeśli nie wiesz, jak interpretować wytyczne lub masz trudności z wykonaniem obliczeń, nasi Eksperci z CMC z pewnością pomogą.
Czy można uniknąć kosztownych testów środowiskowych?
Tak. W niektórych przypadkach pominięcie wykonania badań do ERA jest uzasadnione. Dzieje się tak np. w przypadku wprowadzenia na rynek produktu generycznego, hybrydowego lub zawierającego substancje o ugruntowanym zastosowaniu medycznym (ang. well-established use, WEU). Nie zwalnia to jednak z obowiązku przedstawienia stosownego uzasadnienia, rozpatrującego wpływ na środowisko. W szczególności pod kątem możliwości istotnego wzrostu narażenia środowiska na substancję leczniczą. Jeśli zastanawiasz się, jak napisać odpowiednie uzasadnienie – możemy Ci pomóc.
Dlaczego warto skorzystać z naszego doświadczenia?
Nasi Eksperci mają szeroką wiedzę wynikającą z różnorodności ocen ERA przeprowadzonych dla rozmaitych produktów leczniczych i substancji czynnych. Mamy doświadczenie w przygotowaniu ERA do wszystkich rodzajów procedur, w których uczestniczyły przeróżne kraje europejskie. Jeśli zastanawiasz się, czy ocena ERA dotyczy Twojego produktu i chcesz, aby została napisana przez jednego z naszych Ekspertów, zapraszamy do kontaktu.
Chcesz się dowiedzieć więcej? Potrzebujesz pomocy w przygotowaniu ERA? Chcesz wiedzieć, jak uzasadnić brak badań ERA? Skontaktuj się z nami bezpośrednio.

