
-
Rozwój produktu leczniczego
-
Badania kliniczne
-
Jakość
-
Audyty GxP
-
Usługi Rejestracyjne
-
Wsparcie przedrejestracyjne
- Usługa Scientific Advice
-
Druki informacyjne
-
Dokumentacja rejestracyjna
- Audyt dossier
- Proces rejestracji
- Obsługa porejestracyjna
- Regulatory outsourcing
-
Wsparcie przedrejestracyjne
-
Pharmacovigilance
-
Usługa QP / Import
Zanieczyszczenia i Genotoksyczność
Pojęcie zanieczyszczeń i ich źródła
Zanieczyszczenia są to substancje obce, których obecność w produkcie leczniczym bądź surowcu służącym do wytworzenia takiego produktu jest niepożądana i powinna być ściśle kontrolowana. Zanieczyszczenia w substancjach czynnych (API – Active Pharmaceutical Ingredient) oraz produktach gotowych mogą wpływać na ich jakość, bezpieczeństwo oraz skuteczność.
Do głównych źródeł zanieczyszczeń należą:
- Materiały wyjściowe
- Substancje czynne i pomocnicze
- Warunki procesu produkcyjnego
- Technologia wytwarzania
- Materiały opakowaniowe
- Warunki transportu i przechowywania
- Czynnik ludzki (kontaminacja).
Aby uniknąć negatywnego wpływu produktu na zdrowie pacjenta, należy zapewnić odpowiednią kontrolę zanieczyszczeń w produktach leczniczych. Służą temu wytyczne opracowane przez Międzynarodową Konferencję ds. Harmonizacji (International Council for Harmonisation), m.in. ICH Q3A i Q3B, które dotyczą oceny i kontroli zanieczyszczeń w substancjach czynnych i produktach leczniczych.
Jakie są główne założenia wytycznych ICH Q3A i Q3B?
Wytyczna ICH Q3A dotyczy identyfikacji, klasyfikacji i doboru limitów zanieczyszczeń w substancjach czynnych. Wyróżnia 3 typy zanieczyszczeń:
- zanieczyszczenia organiczne – pochodzące głównie z procesów syntezy chemicznej. Mogą to być produkty uboczne reakcji, pozostałości materiałów wyjściowych, lub produkty rozkładu substancji czynnej;
- zanieczyszczenia nieorganiczne – pozostałości katalizatorów metalicznych, woda, substancje pochodzące z użytych odczynników lub z wyposażenia produkcyjnego (temat zanieczyszczeń metalami wyczerpuje wpis „Analiza ryzyka zanieczyszczeń elementarnych w produktach leczniczych” na stronie SciencePharma, a także wytyczna ICH Q3D);
- rozpuszczalniki – pozostałości rozpuszczalników organicznych używanych podczas syntezy (reguły klasyfikacji rozpuszczalników i doboru ich limitów zostały omówione szczegółowo w wytycznej ICH Q3C).
Wytyczna ICH Q3B porusza kwestie zanieczyszczeń w gotowych produktach leczniczych. Tego rodzaju zanieczyszczenia można podzielić na:
- zanieczyszczenia pochodzące z API – mogą to być substancje nieorganiczne, organiczne lub pozostałości rozpuszczalników, które nie zostały usunięte w procesie wytwarzania produktu końcowego;
- zanieczyszczenia wynikające z procesów produkcji – obejmują produkty degradacji powstające podczas wytwarzania, przechowywania, w wyniku interakcji z opakowaniami lub procesów technologicznych.
Limity zanieczyszczeń

Limity zanieczyszczeń zarówno w API jak i w produktach końcowych zależą od maksymalnej dawki dobowej leku. Zanieczyszczenia powyżej określonych progów muszą zostać zidentyfikowane i ocenione pod kątem ich toksyczności. Producenci zobligowani są monitorować poziomy zanieczyszczeń oraz przeprowadzać badania stabilności, które określają czy w miarę upływu czasu lub pod wpływem niekorzystnych warunków przechowywania poziomy te nie wzrastają.
Zastosowanie powyższych wytycznych jest doskonale znane ekspertom SciencePharma, którzy przygotowali jak dotąd wiele opracowań dotyczących ustalenia czy też uzasadnienia limitów zanieczyszczeń na rzecz swoich Klientów, które były akceptowane przez organy kompetentne. W SciencePharma wiemy jak ważne jest bezpieczeństwo pacjentów, nie zapominając przy tym o odpowiedniej jakości i skuteczności leku. Zatem jeśli borykasz się z podobnymi problemami, zgłoś się do nas!
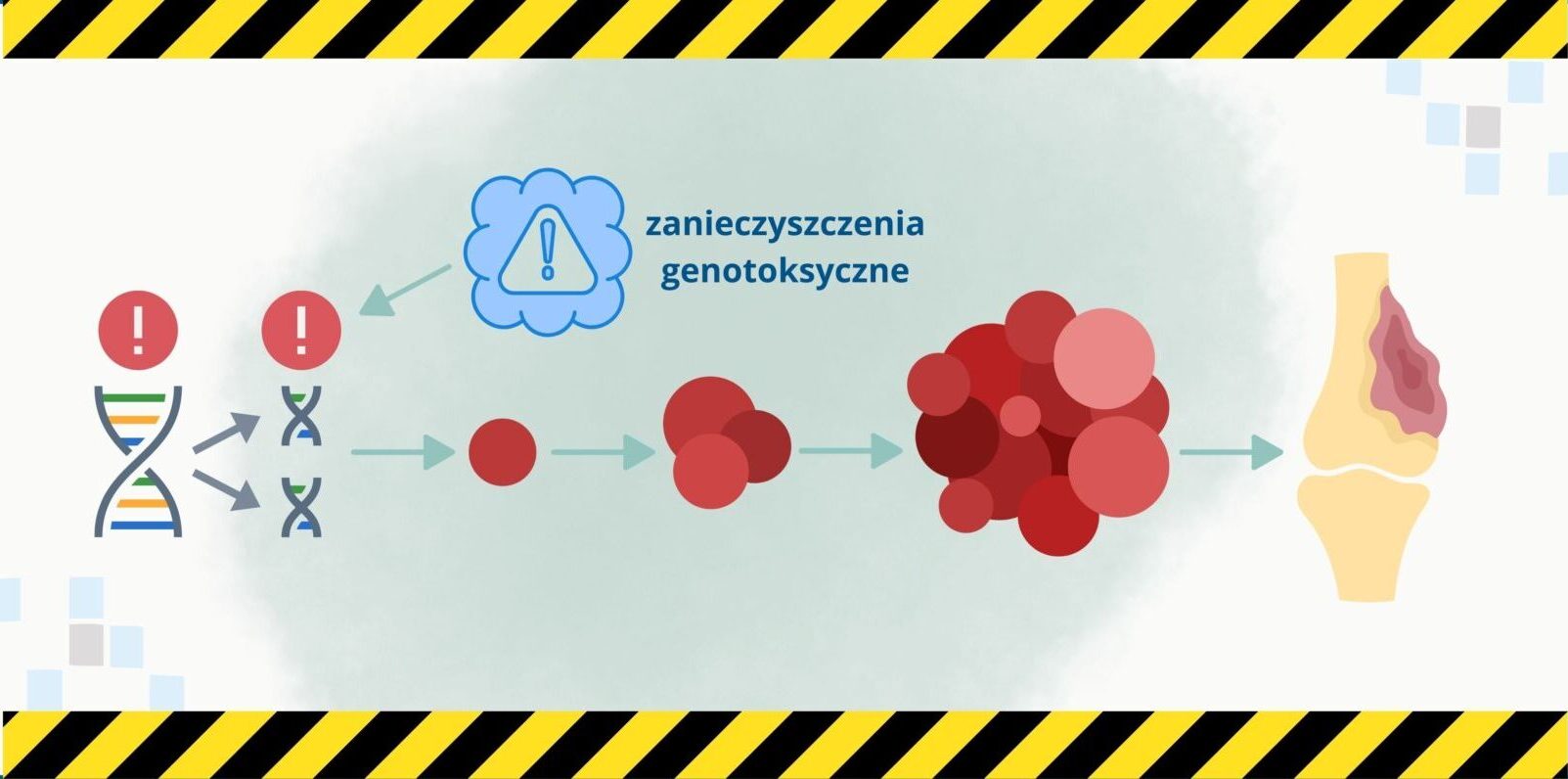
Czym są zanieczyszczenia genotoksyczne?
Szczególnym rodzajem zanieczyszczeń, które wyłamują się spod wspomnianych wcześniej wytycznych są zanieczyszczenia genotoksyczne. Stanowią istotne zagrożenie dla zdrowia pacjentów, ponieważ mogą wywoływać mutacje w DNA, prowadzące do nowotworów. W celu minimalizacji tego ryzyka, wprowadzono kontrolę zanieczyszczeń o potencjalnym działaniu genotoksycznym w produktach leczniczych, co opisuje wytyczna ICH M7, odnosząca się zarówno do substancji czynnych, jak i produktów gotowych.
Ocena ryzyka mutagenności
Wytyczna ICH M7 klasyfikuje zanieczyszczenia genotoksyczne według potencjału mutagennego na podstawie danych doświadczalnych oraz oceny struktury chemicznej. Wyróżnia pięć klas:
- Klasa 1: Zanieczyszczenia o znanej mutagenności i kancerogenności
- Klasa 2: Zanieczyszczenia o potencjale mutagennym, dla których ustala się dopuszczalne wartości narażenia
- Klasa 3: Substancje potencjalnie genotoksyczne na bazie ich struktury, wymagające dalszej analizy
- Klasa 4: Substancje potencjalnie genotoksyczne, pochodne API
- Klasa 5: Zanieczyszczenia, które należy uznać na podstawie dostępnych danych za niemutagenne.
Metody badań substancji potencjalnie mutagennych obejmują zarówno ocenę strukturalną (modelowanie QSAR), jak i testy biologiczne (np. na szczepach bakterii – test Amesa). Ponadto zalecane jest wdrożenie odpowiednich strategii kontroli procesów produkcyjnych lub zmian w ścieżkach syntezy, w celu minimalizacji ryzyka powstawania tego typu zanieczyszczeń.
Wytyczna ICH M7 wprowadza koncepcję progu zagrożenia toksykologicznego TTC (threshold of toxicological concern). Próg ten jest wyrażony jako akceptowalny dzienny limit, który stwarza nikłe (mniej niż 1 na 100000 przypadków) ryzyko wystąpienia nowotworów oraz toksycznych efektów. Zależy on od czasu terapii oraz przyjmowanej dawki leku. Zgodnie z wytyczną wartość TTC nie powinna być wyższa niż 1,5 µg dziennie.
Jednak co w przypadku gdy wartość ta zostaje przekroczona? Jaka jest procedura działania, jeśli rozpatrywane zanieczyszczenie wykazuje alerty strukturalne, ale nie ma potwierdzonej mutagenności?
Na te, jak również inne pytania odpowiedzą eksperci SciencePharma! Pomogą Ci zaklasyfikować dane zanieczyszczenia, ustalić dla nich limity, czy też uzasadnić przypadki, w których kontrola zanieczyszczeń genotoksycznych nie jest konieczna, lub dozwolone są wyższe progi akceptacji.
Dlaczego warto z nami współpracować?
Jeśli potrzebujesz fachowej porady, skontaktuj się z nami!
Uzyskasz pomoc i dowiesz się jak:
- przeanalizować możliwe źródła zanieczyszczeń, ich potencjalną toksyczność oraz metody kontroli;
- ustalić limity zanieczyszczeń, uzasadnić przekroczenie wartości zawartych w wytycznych lub odejście od badań poziomu zanieczyszczeń w trakcie przechowywania produktu.
SciencePharma zapewnia wsparcie w tym zakresie, bazując na dużym doświadczeniu i podchodząc indywidualnie do każdego rozpatrywanego przypadku. Nasza pomoc pozwoli Ci ograniczyć liczbę przeprowadzanych analiz do tych niezbędnych, oszczędzając czas i koszty, przy równoczesnym zachowaniu wysokiej jakości i zgodności z wymogami regulacyjnymi.
Źródła:
ICH Q3A Impurities in New Drug Substances
https://www.ema.europa.eu/en/ich-q3a-r2-impurities-new-drug-substances-scientific-guideline
ICH Q3B Impurities in New Drug Products
https://www.ema.europa.eu/en/ich-q3b-r2-impurities-new-drug-products-scientific-guideline
ICH M7 Guideline on assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk

