-
Rozwój produktu leczniczego
-
Badania kliniczne
-
Jakość
-
Audyty GxP
-
Usługi Rejestracyjne
-
Wsparcie przedrejestracyjne
- Usługa Scientific Advice
-
Druki informacyjne
-
Dokumentacja rejestracyjna
- Audyt dossier
- Proces rejestracji
- Obsługa porejestracyjna
- Regulatory outsourcing
-
Wsparcie przedrejestracyjne
-
Pharmacovigilance
-
Usługa QP / Import
System Pharmacovigilance (PSMF)
Pharmacovigilance (PhV) to inaczej nadzór nad bezpieczeństwem farmakoterapii, do którego zobowiązany jest każdy Podmiot odpowiedzialny posiadający pozwolenia na dopuszczenie do obrotu produktów leczniczych. Nasz Zespół posiada niezbędną wiedzę i doświadczenie pozwalające na wykonywanie czynności związanych z wykrywaniem, oceną, zrozumieniem i raportowaniem działań niepożądanych.
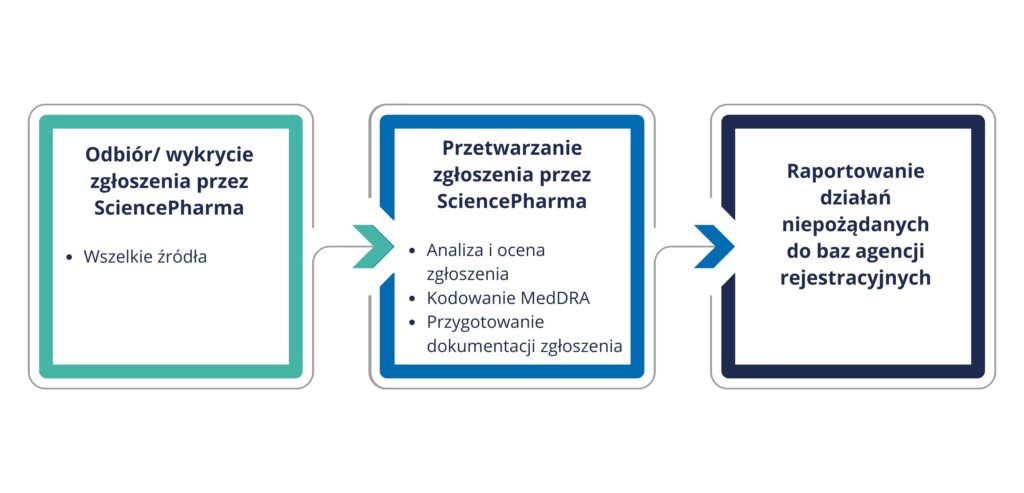
SciencePharma stworzyła pełen system nadzoru nad bezpieczeństwem farmakoterapii wraz z odpowiednim systemem jakości stosując się do wytycznych zawartych w Good Pharmacovigilance Practices (GVP) i oferuje go swoim Klientom. Każda z firm farmaceutycznych korzystająca z naszych usług włączana jest do systemu kompatybilnego z wymaganiami europejskimi.
Nasz doświadczony i ciągle kształcący się Zespół zapewnia:
- Całościowe zarządzanie pojedynczym przypadkiem działania niepożądanego (odbiór/wykrycie, przetwarzanie, kodowanie według terminologii MedDRA, analiza i ocena medyczna, follow-up, raportowanie)
- Wykrywanie sygnałów
- Przygotowanie okresowych raportów bezpieczeństwa (Periodic Safety Update Report‑PSUR) i terminowe składanie ich do odpowiednich agencji rejestracyjnych
- Przygotowanie raportów uzupełniających (Addendum to Clinical Overview) do celów rerejestracji
- Cotygodniowe przeglądy piśmiennictwa
- Doradztwo lub pełna rejestracja Podmiotu odpowiedzialnego do bazy EudraVigilance
- Elektroniczne raportowanie do agencji europejskiej (EMA) lub innych agencji rejestracyjnych poprzez aplikację EVWEB lub bramkę firmy
- Wprowadzanie i aktualizacja informacji o produktach w bazie XEVMPD
- Zapewnienie osoby odpowiedzialnej za EudraVigilance (EV responsible person) – osoby reprezentującej firmę w procesie rejestracji w EudraVigilance
- Przygotowanie pełnego opisu systemu monitorowania działań niepożądanych produktów leczniczych (PSMF) dostosowanego do potrzeb firmy
- Przygotowanie Systemu zarządzania ryzykiem produktu leczniczego dla poszczególnych produktów – niezbędnego elementu każdej dokumentacji rejestracyjnej (Moduł 1.8.2 dokumentacji rejestracyjnej)
- Przeprowadzanie oceny/audytu systemu monitorowania działań niepożądanych produktów leczniczych ze wskazaniem braków i doradztwem w zakresie ich uzupełnienia (link do zakładki Audyty > PhV)
- Usługi jako lokalny punkt kontaktowy Pharmacovigilance zapewniając zgodność z polskimi wymaganiami
Oferujemy naszym klientom całościowe lub częściowe usługi z zakresu Pharmacovigilance.

