
进口与供应链管理
对于希望将药品引入欧盟市场的非欧盟/欧洲经济区(EEA)地区制造的药品的所有市场授权持有人(MAHs),需要有负责批次认证的药品进口商。药品进口到欧盟国家是SciencePharma提供的核心服务之一,旨在支持来自第三国(非欧盟/EEA)医疗产品在欧洲市场的存在。我们提供全面的进口服务,并确保对符合欧盟法律法规以及GMP/GDP的专业验证。
关于在欧盟以外制造的药品,进口商的欧盟GMP要求
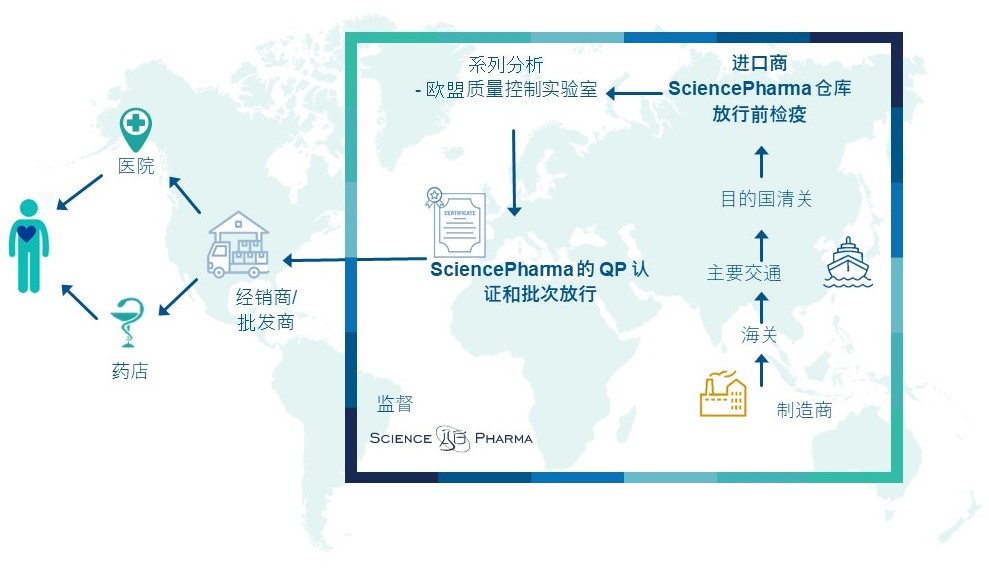
在将药品进口到欧盟时适用的要求在欧盟GMP指南中进行了描述,并在2022年8月生效的新附录21中进行了总结。根据附录21,在进口过程中,我们可以区分以下与其相应活动相关的地点:
- 实体进口地点,主要负责接收进口产品
- 批次认证地点,或对于进一步加工的散装或中间产品,进行合格人员(QP)确认。

欧盟进口商 – MIA许可证和符合GMP的药品质量体系
鉴于其特定的进口责任,上述地点需要持有相关的制造和进口授权许可证(MIA许可证)以及根据所开展活动的范围实施适当的符合GMP的药品质量体系。在SciencePharma,我们满足这一要求,并作为合格的合作伙伴,雇佣经验丰富的专家,能够全面执行进口流程。SciencePharma持有自己的MIA许可证。如有需要,我们还可以依赖经过验证的长期合作伙伴的MIA许可证,为所有所需的进口活动提供一站式进口服务。
SciencePharma提供以下进口服务:全球运输组织、仓储、分销和供应链管理。
SciencePharma的专家在管理药品进口方面拥有丰富的经验。我们按照良好生产规范(GMP)和良好分销规范(GDP)进行工作。我们提供全面的进口服务,照顾到所有阶段,包括:全球运输组织、仓储、分销和供应链管理。我们活动的一个重要部分是与位于欧盟各地的合同质量实验室进行批次控制研究。
我们在以下领域拥有广泛的知识和经验:
- 与可靠的运输公司合作进行运输(航空、道路、海运和铁路运输)
- 与海关机构(在制造国和目的国)合作进行清关
- 评估存储条件
- 在实体进口地点进行产品存储
- 投诉和质量缺陷管理
- 序列化警报监督
- 质量控制研究的委托和监督
- 将分析方法转移到位于欧盟的实验室的管理
- 仓库组织与管理
- 从时间和成本节约的角度进行全面的供应链监督和优化
以及在欧盟市场推出药物时必须执行的许多其他活动。我们进口活动的一个明显且重要的部分是与位于欧盟各地的合同质量控制实验室进行批次分析。为了完善综合服务,我们还提供最高质量的合格人员服务(批次认证)和批次放行。
分发过程
此外,我们根据GDP要求监督分发过程,从产品订单开始,贯穿进口过程和储存环节。我们控制所有物流事务,确保分发的产品在整个分发过程中质量得到保持,符合GDP要求。
此外,我们的专家拥有从市场采购和运输参考产品的经验,这些产品用于开发CMC研究和临床试验——无论是来自欧盟还是第三国。在临床试验药品(IMPs)的情况下,我们组织IMPs的分发,确保IMPs在适当控制的条件下按时送达各个临床站点,符合现行法律法规以及GMP/GDP的要求。我们还提供临床研究用的临床试验药品再包装协调服务,确保符合GMP标准。
SciencePharma专家在全球范围内提供制造和进口服务方面拥有丰富经验。
SciencePharma为全球各地的小型、中型和大型制药公司提供服务。我们的专家在制造和进口活动方面拥有丰富经验,服务对象包括来自亚洲、南美洲、美国以及欧盟以外的欧洲国家的客户,这些客户在这些地区生产药品。我们的优势在于对欧盟法律以及各国特定法律要求、程序和注册机构的期望拥有深入的了解,这为产品进口和整个制药监管支持以及项目管理的成功奠定了基础。
计划进口药品吗?
我们将帮助您解决所有监管、运输和海关清关的挑战。与我们合作,您可以确保进口过程顺利、无忧。让我们代表您处理所有的操作和进口手续。
